

Galvanische Zellen wandeln chemische Energie in elektrische Energie um, wie zum Beispiel in Akkumulatoren. Dabei laufen Reduktion und Oxidation der verwendeten Substanz räumlich getrennt in einer der beiden Halbzellen ab, die durch Verbinden mit einem Elektronenleiter und einem Ionenleiter zu einem Stromkreis geschlossen sind. Eine Brennstoffzelle besteht aus einer galvanische Zelle, bei der Brennstoff (z. B. Wasserstoff) und Oxidationsmittel (z. B. Sauerstoff) ständig zugeführt werden und damit kontinuierlich aus chemischer Energie elektrische Energie erzeugen.


Die erste noch als Gasbatterie bezeichnete Brennstoffzelle, siehe unten, erfanden 1838/1839 Christian Friedrich Schönbein und William Robert Grove. Die Gefäße der unteren Abbildung (Fig. 180 aus W. Ostwald, Elektrochemie, Leipzig 1896) sind mit verdünnter Schwefelsäure gefüllt. Die acht Kolben, die die Platin-Elektroden in den vier unteren Zellen umhüllen, werden vor der Inbetriebnahme mit Sauerstoff oder Wasserstoff gefüllt. Durch die entstehende galvanische Spannung fließt ein Strom über den Verbraucher, und die Gase in den Kolben wandeln sich über H+ und O2− in Wasser um.
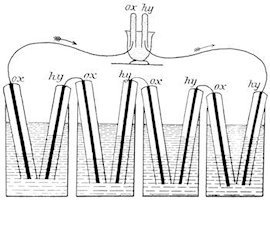
In der Abbildung ist der Verbraucher wiederum eine galvanische Zelle (oberes Gefäß), in der der umgekehrte Vorgang abläuft, also im Kolben befindliches Wasser in Sauerstoff und Wasserstoff zerlegt wird.
Die Zukunftsvision für die Brennstoffzelle formulierte Jules Verne im Jahre 1877: Das Wasser ist die Kohle der Zukunft. Die Energie von morgen ist Wasser, das durch elektrischen Strom zerlegt worden ist. Die so zerlegten Elemente des Wassers, Wasserstoff und Sauerstoff, werden auf unabsehbare Zeit hinaus die Energieversorgung der Erde sichern.
Auf einen wesentlichen Unterschied der Brennstoffzellen zu den mehrheitlich für die Stromerzeugung eingesetzten Wärmekraftmaschinen wies 1894 Wilhelm Ostwald hin: Die Effizienz der Brennstoffzellen ist nicht durch den Carnot-Wirkungsgrad begrenzt. Deshalb können sie bei niedrigen Temperaturen betrieben werden.
Die Entwicklung technisch nutzbarer Brennstoffzellen für Raumfahrt und militärische Anwendungen begann in der zweiten Hälfte des 20. Jahrhunderts. Inzwischen sind zahlreiche Anwendungsgebiete erschlossen. Bei der einzelnen Brennstoffzelle, die eine Spannung von etwa einem Volt erzeugt, sind die aus einem Elektronen leitenden Material hergestellte Anode und Kathode durch eine Ionen leitende dünne Schicht getrennt. Größere Betriebsspannungen werden durch Stapelung solcher Zellen erreicht.
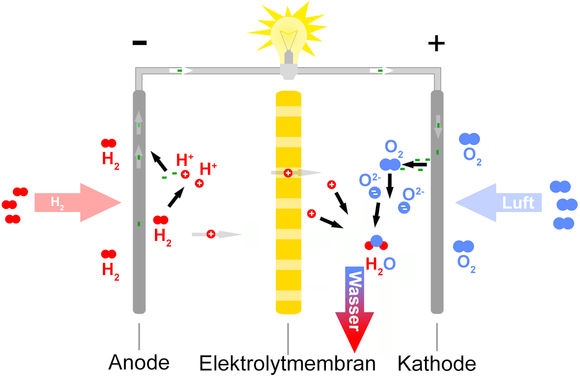
Linkstehende Abbildung zeigt den für alle Brennstoffzellen gültigen schematischen Aufbau, wobei Wasserstoff durch organische Verbindungen wie z.B. Methan oder Methanol und der reine Sauerstoff durch Luft mit einem Anteil von ca. 20 % Sauerstoff ersetzt werden können.
An der Anode läuft die Oxidationsreaktion (Elektronenabgabe)
und an der Kathode die Reduktionsreaktion (Elektronenaufnahme)
Insgesamt entsteht das umweltfreundliche Abgasprodukt Wasser durch
Bei 70 °C wird die Protonenaustauschmembran-Brennstoffzelle (proton exchange membrane fuel cell, PEMFC) betrieben. Sie verwendet für die Elektrolytmembran ein gasdichtes und nicht Elektronen-leitendes aber Protonen-leitendes Ionomer (thermoplastischer Kunststoff). Der Wirkungsgrad bei der Erzeugung elektrischer Energie erreicht 35 %. Eine Erhöhung des Wirkungsgrads auf 47 % ermöglicht die bei etwa 900 °C arbeitende Festoxidbrennstoffzelle (solid oxide fuel cell, SOFC). Die meist aus Yttrium-dotiertem Zirkonium hergestellte Elektrolytmembran hat eine gute Leitfähigkeit für Ionen des Sauerstoffs und ist nicht-leitend für die Elektronen. Ausführliche Darstellungen der verschiedenen Zellen sowie der stationären und mobilen Anwendungen bieten "Planet Wissen" und Wikipedia.
<